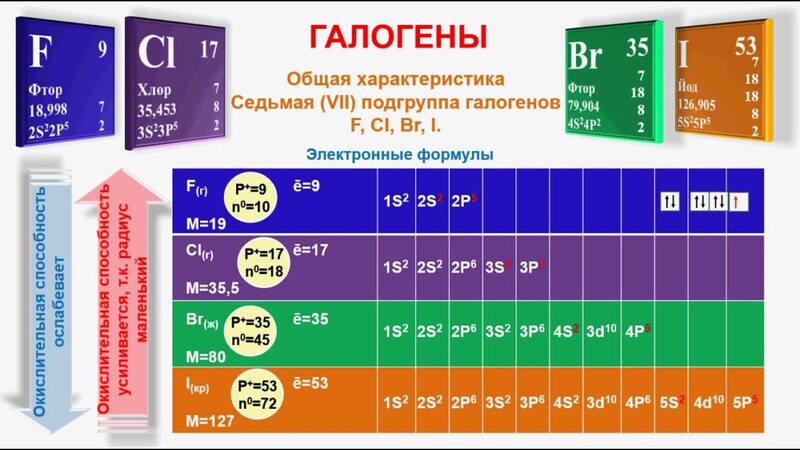
Мы рассмотрели реакции щелочных металлов с хлором с целью выявления сходства щелочных металлов. Подобным же образом взаимодействие галогенов с одним из щелочных металлов, например натрием, свидетельствует о том, что они имеют общие свойства. Между галогенами и металлическим натрием происходят следующие реакции:
Na (тв) + ? F2 (г) ? NaF (тв) + Тепло
Na (тв) + ? Cl2 (г) ? NaCl (тв) + Тепло
Na (тв) + ? Br2 (г) ? NaBr (тв) + Тепло
Na (тв) + ? I2 (г) ? NaI (тв) + Тепло
Все эти реакции протекают очень легко и приводят к образованию ионных твердых веществ с общей формулой NaX. Кристаллическая решетка каждого из этих веществ состоит из положительно заряженных атомов натрия и отрицательно заряженных атомов галогена. Отрицательные ионы F-, CI-, Вr и I- называются галоген-ионами. Устойчивость этих ионов можно связать с устойчивостью электронной конфигурации соответствующего инертного газа.
Галогены взаимодействуют также с водородом с образованием галогеноводородов:
H2 (г) + F2 (г) ? 2HF (г) Фтористый водород
H2 (г) + Cl2 (г) ? 2HCl (г) Хлористый водород
H2 (г) + Br2 (г) ? 2HBr (г) Бромистый водород
H2 (г) + I2 (г) ? 2HI (г) Йодистый водород
Ни одна из этих реакций не протекает легко при комнатной температуре. Это происходит потому, что сначала должны разорваться связи, удерживающие атомы в молекулах водорода и галогена, а затем образуются новые связи между атомами водорода и атомами галогена. Разрыву связей способствует высокая температура, и, начавшись, эти реакции, протекают быстро, а иногда даже с взрывом.



